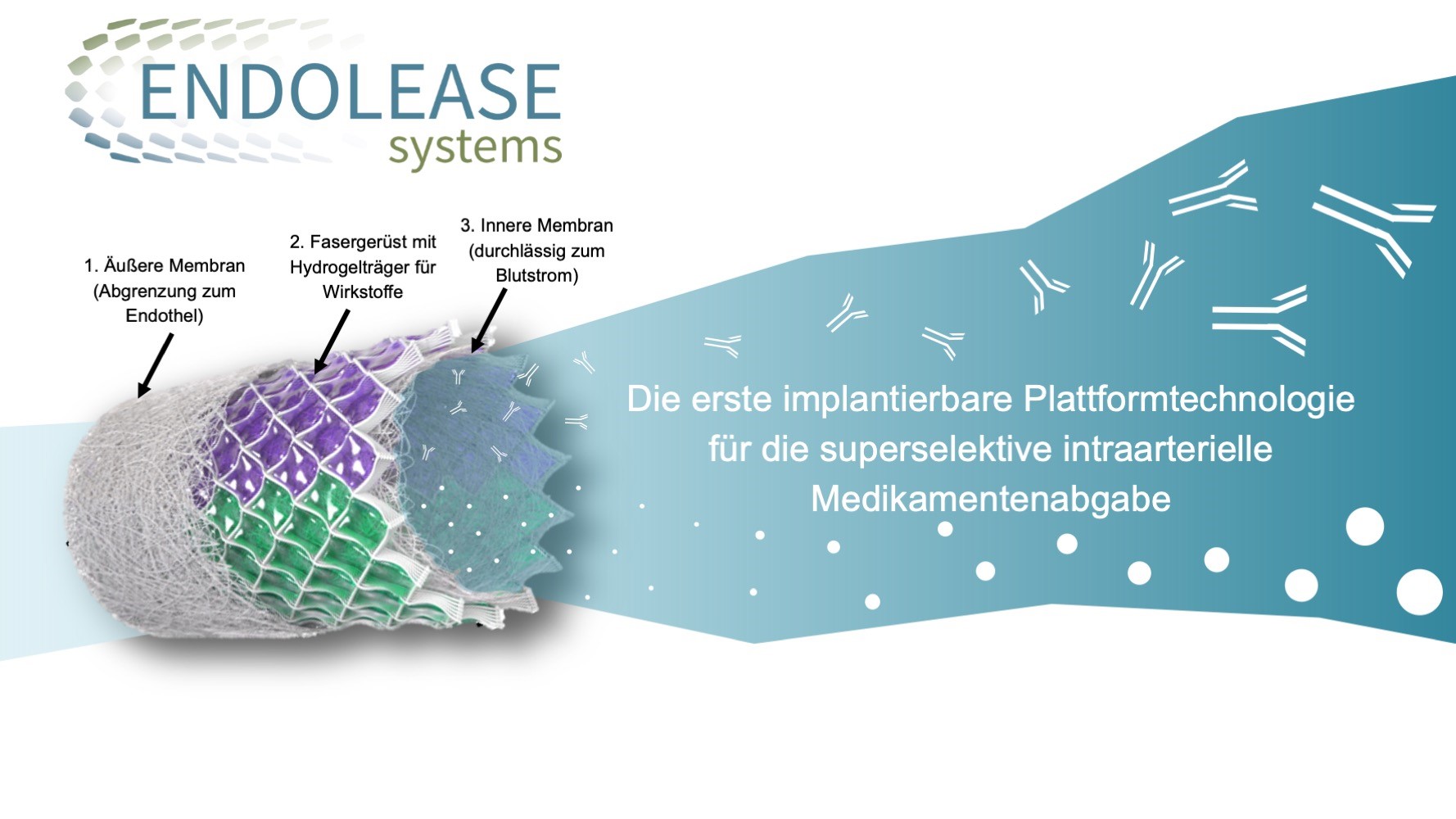
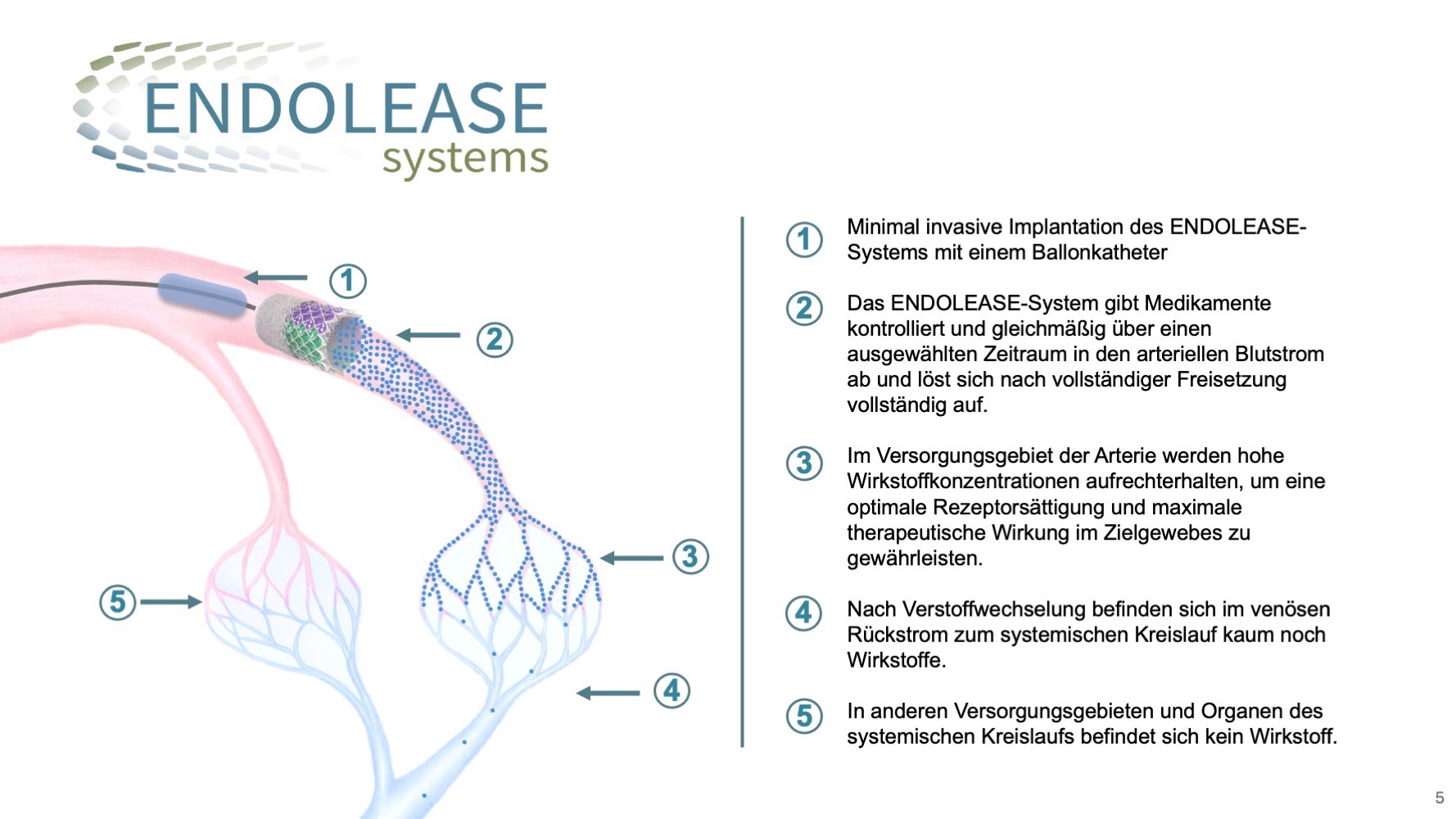

Würzburg. Nach dem Gewinn der ersten beiden Phasen des Businessplan Wettbewerbs Nordbayern (BayStartUP) überzeugte das Team von ENDOLEASE nun auch in der dritten und finalen Phase. Damit sicherte sich das Team um Anna Fleischer und Johannes Braig nicht nur ein weiteres Preisgeld in Höhe von 10.000 Euro, sondern auch die Auszeichnung als eines der vielversprechendsten MedTech-Projekte der Region. ENDOLEASE steht für „ENDOvascular reLEASE“. Dabei handelt es sich um die weltweit erste implantierbare Plattformtechnologie zur superselektiven, intraarteriellen Wirkstofffreisetzung. So funktioniert es: Das ENDOLEASE-System wird mit einem Ballonkatheter minimal-invasiv in eine Arterie platziert, die zum Zielgewebe führt. Die äußere Membran des bioresorbierbaren, röhrenförmigen Implantats grenzt das System vom Endothel ab. Darunter befindet sich ein Fasergerüst mit einem Hydrogelträger für die Wirkstoffe. Die Wirkstoffe werden über die innere Membran kontrolliert und gleichmäßig in den arteriellen Blutstrom abgegeben, sodass ausschließlich im Versorgungsgebiet der Arterie eine hohe Wirkstoffkonzentration erreicht wird. Dies steigert die Wirksamkeit, minimiert systemische Nebenwirkungen und erweitert das therapeutische Fenster, wodurch neue Therapieoptionen für schwer behandelbare Erkrankungen entstehen.
Mit ihrer innovativen Idee und der bisherigen Entwicklungsleistung konnte das Team des Uniklinikums Würzburg bereits bei verschiedensten Wettbewerben überzeugen und wichtige Fördermittel einwerben. Im Interview schildern Dr. Anna Fleischer (34) aus der Medizinischen Klinik und Poliklinik II sowie Johannes Braig (31) vom Lehrstuhl für Funktionswerkstoffe der Medizin und der Zahnheilkunde FMZ, wie aus einer klinischen Beobachtung eine innovative Idee wurde, wie interdisziplinäre Zusammenarbeit und Unterstützung aus Würzburg das Projekt möglich machen, und wohin die Reise mit ENDOLEASE noch gehen soll.
Herzlichen Glückwunsch! Ihr habt gerade die dritte Phase des Businessplan Wettbewerbs Nordbayern gewonnen. Worum geht es denn in den einzelnen Phasen?
Anna Fleischer: Vielen Dank! Wir haben uns riesig über die Auszeichnung gefreut. In Phase 1 ging es um die Geschäftsidee und den Kundennutzen. In Phase 2 standen Marketing und Vertrieb im Mittelpunkt und in der dritten Phase lag der Fokus auf der Umsetzungsstrategie und Finanzierung. Dass wir in allen drei Phasen überzeugen konnten, freut uns sehr und zeigt, dass unser Konzept als tragfähig anerkannt wurde.
Was haben euch die einzelnen Phasen gebracht?
Johannes Braig: Neben dem Preisgeld war vor allem die Sichtbarkeit für uns enorm wertvoll. So haben sich bereits potenzielle Investoren, Business Angels und strategische Partner gemeldet, die uns gern mit ihrer Expertise und privatem Kapital unterstützen möchten.
Anna: Auch unabhängig vom Wettbewerbserfolg haben wir viel gelernt. Die strukturierte Begleitung durch jede Phase hat uns geholfen, unser Geschäftsmodell strategisch weiterzuentwickeln. Besonders hilfreich war das schriftliche Feedback der Jury, die aus erfahrenen Unternehmern, Investoren und Branchenexpert:innen bestand. Das hat uns immer wieder neue Perspektiven eröffnet – und das Projekt entscheidend vorangebracht.
Anna, du hattest die Idee zu ENDOLEASE. Wie kam es dazu?
Anna: Die Theorie zu ENDOLEASE entstand tatsächlich aus einem konkreten klinischen Erlebnis – aber praktisch zum Leben erweckt wurde sie durch die engagierte Zusammenarbeit mit vielen großartigen Mitstreitern. Während einer Kontrastmitteluntersuchung habe ich damals gespürt, wie präzise sich Substanzen über eine bestimmte Arterie in das Kapillargebiet eines Zielorgans leiten lassen. Da kam mir der Gedanke: Was wäre, wenn wir diese Route gezielt nutzen könnten, um Medikamente lokal – und über einen genau definierten Zeitraum – in erkranktes Gewebe einzubringen? Statt den ganzen Körper systemisch mit hohen Wirkstoffdosen zu belasten, könnten wir die Substanzen gezielt dort freisetzen, wo sie wirklich gebraucht werden. Mit minimaler Dosis, aber maximaler lokaler Wirkung
Ihr nutzt die Kapillaren, um die therapeutische Wirksamkeit im Zielgewebe zu steigern und gleichzeitig systemische Nebenwirkungen drastisch zu reduzieren. Wie funktioniert das?
Anna: Millionen Jahre Evolution haben die Kapillaren zu hochspezialisierten Strukturen für den Stoffaustausch zwischen Blut und Gewebe geformt. ENDOLEASE nutzt genau diesen physiologischen Mechanismus: Die Wirkstoffe erreichen punktgenau das Zielgewebe, werden dort in hoher Konzentration aufgenommen und entfalten ihre Wirkung – ohne systemisch relevante Konzentrationen zu verursachen. Im venösen Rückstrom werden die verbleibenden Wirkstoffreste stark verdünnt – ein natürlicher Effekt, der die systemische Belastung minimiert.
Kannst du ein Beispiel für die Anwendung nennen?
Bei einer Chemotherapie zum Beispiel könnte der Wirkstoff gezielt und hochkonzentriert auf einen soliden Tumor wirken, ohne sich im gesamten Blutvolumen zu verteilen – und so möglicherweise typische Nebenwirkungen wie Übelkeit, Herz- oder Leberschäden oder Neuropathien deutlich verringern.
Aber auch andere medizinische Fachbereiche können von ENDOLEASE profitieren.
Anna: Genau. Nachdem ich das Konzept systematisch weiterentwickelt und erste Funktionsmodelle skizziert hatte, sprach ich Key Opinion Leader aus rund einem Dutzend Fachabteilungen an, die in Letters of Intent ihre Unterstützung bei der Translation der ENDOLEASE-Plattformtechnologie zusicherten. Wir sind äußerst dankbar, so viele engagierte und erfahrene Mitstreiterinnen und Mitstreiter aus ganz unterschiedlichen Disziplinen an unserer Seite zu wissen. Diese interdisziplinäre Rückendeckung ist für uns von unschätzbarem Wert.
Wie und wann kam die Biofabrikation ins Spiel?
Anna: Im Rahmen der Patentanmeldung wurde mir schnell klar, dass ich für die technische Umsetzung starke Partner brauche. Ich hatte zwar eine klare Vision von den funktionellen Eigenschaften, die das System erfüllen sollte – von der gezielten Wirkstofffreisetzungskinetik bis hin zur sicheren, atraumatischen Integration in das Gefäßsystem – doch für die konkrete Entwicklung eines bioresorbierbaren Implantats fehlten mir die ingenieurwissenschaftlichen Ressourcen. Es ist ein großes Glück, direkt vor der Haustür in Würzburg einen Lehrstuhl zu haben, der auf diesem Gebiet führend ist und auf ein so engagiertes und innovatives Team zu treffen.
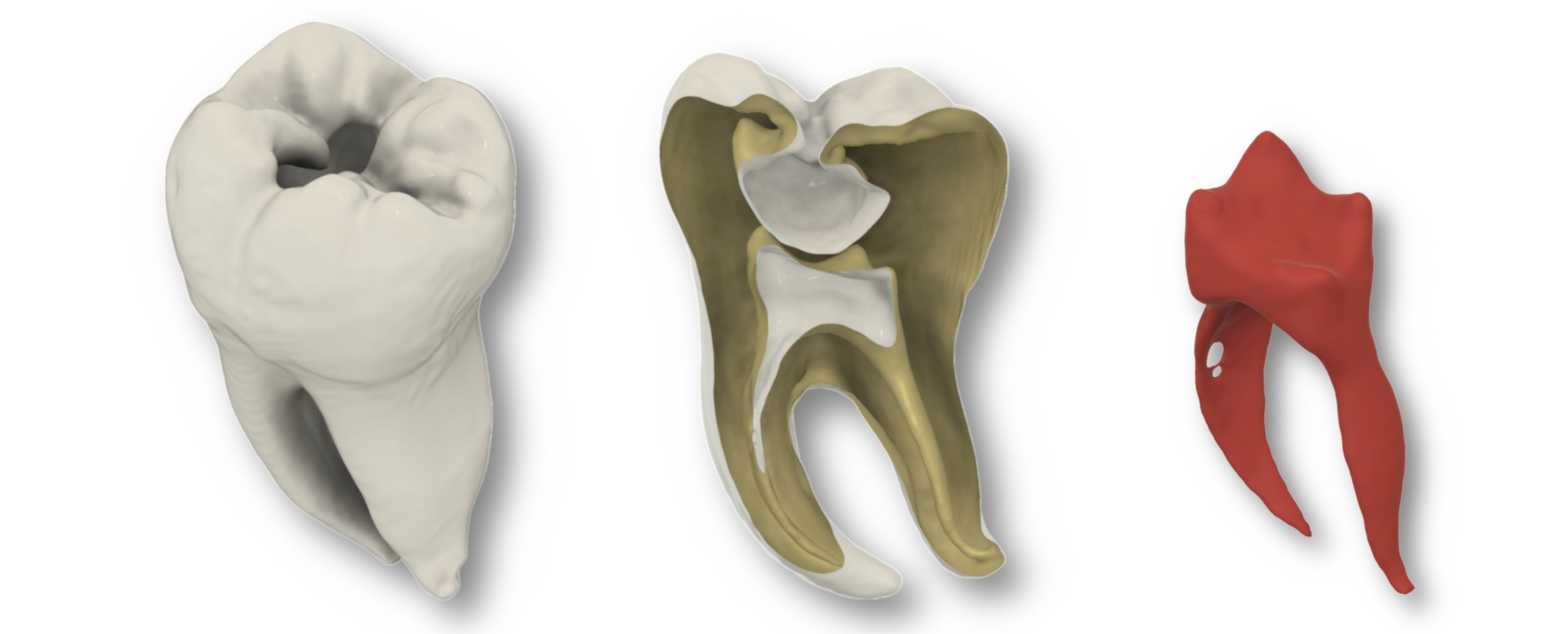
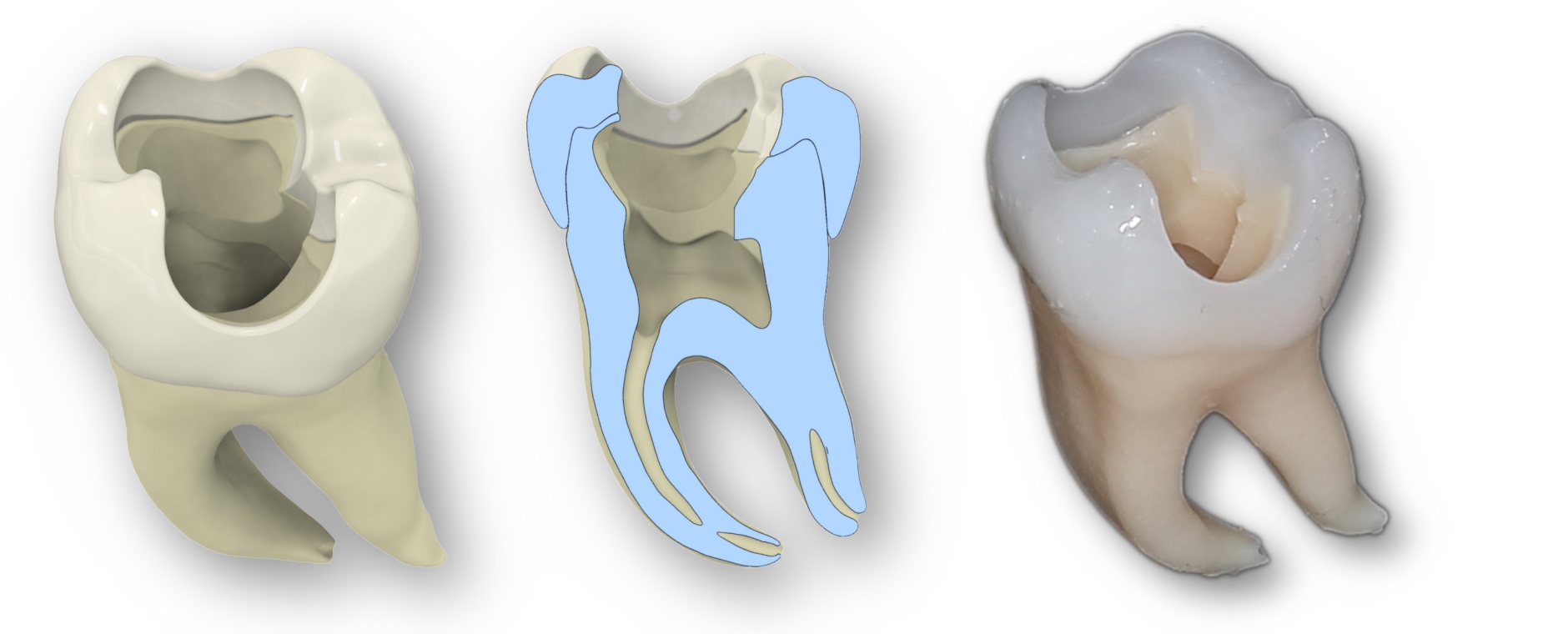
Johannes: Anna stellte das Projekt meinem Doktorvater, Professor Tomasz Jüngst, vor. Mit jedem Satz aus ihrem Mund wurde sein Grinsen breiter. Denn Grundlagen für das, was Anna sich vorstellte, erarbeiteten wir an unserem Lehrstuhl bereits seit vielen Jahren. Wir erforschen, wie sich mithilfe modernster 3D-Drucktechnologie künstliche Blutgefäße herstellen lassen. Dabei nutzen wir ein Verfahren namens Melt Electrowriting, mit dem wir aus extrem feinen Kunststofffasern sogenannte Scaffolds drucken, die wie kleine Röhren aussehen. Diese Gerüste befüllen wir anschließend mit Hydrogelen, die wir mit menschlichen Zellen kultivieren. Innerhalb weniger Tage besiedeln die Zellen das künstliche Gefäßgerüst und bilden eine funktionale Schicht, die der Struktur von echten Blutgefäßen ähnelt.
Statt der menschlichen Zellen bringt ihr bei ENDOLEASE nun Wirkstoffe ein?
Johannes: Richtig. Statt Zellkulturen bringen wir bei ENDOLEASE Medikamente in die Hydrogelstruktur ein – abgestimmt auf die jeweilige Indikation. Tomasz ließ den Postdoc Dr. Michael Bartolf-Kopp, den Doktoranden Franz Moser und mich auf das Projekt los und bat uns, einen Prototypen zu entwickeln, aus dem Wirkstoffe eingebracht und freigesetzt werden können.
Und wie ging es mit dem Businessplan weiter?
Anna: 2023 nahmen wir dann gemeinsam – Klinik und Biofabrikation – an einem sechswöchigen internationalen Bootcamp in Schweden teil, organisiert von BioM und dem schwedischen Biotech-Inkubator SmiLe. Dieses Programm ermöglichte uns, unsere Innovation aus verschiedenen Blickwinkeln zu analysieren, regulatorische Hürden zu verstehen und eine schlüssige Marktstrategie zu formulieren. Online und in München wurde das Programm weitergeführt. Wir haben in dieser Zeit nicht nur viel gelernt, sondern auch als Team enorm an Zusammenhalt gewonnen. Wobei die Zusammenarbeit schon vom ersten Tag an außergewöhnlich konstruktiv, inspirierend und von großem gegenseitigen Respekt geprägt war.
Wer gehört eigentlich mit welchen Aufgaben zum Kernteam von ENDOLEASE?
Anna: Die Projektleitung mit Fokus auf die klinische Translation liegt bei mir. Ich habe Medizin in Würzburg studiert und mich zusätzlich in den Bereichen Gesundheitsökonomie und Translation qualifiziert – mit einem Master of Health Business Administration und einem Master in Translational Medicine. Aktuell bin ich im Rahmen eines Clinician-Scientist-Programms in der Weiterbildung zur Fachärztin für Neurologie und Psychosomatik.
Johannes: Das Team hier am FMZ ist unter der Arbeitsgruppenleitung von Tomasz Jüngst für die technische Entwicklung zuständig. Michael Bartolf-Kopp ist als PostDoc über den Medical-Valley-Award angestellt. Zum Team gehören noch der zahnmedizinische Doktorand Florian Mattern und die beiden pharmazeutischen Doktoranden Lina Tschauder und Maurice Simon. Ich selbst komme ursprünglich aus den Ingenieurwissenschaften, stehe kurz vor dem Abschluss meiner naturwissenschaftlichen Promotion und studiere aktuell im zehnten Semester Humanmedizin. Meine Rolle ist die Brücke zwischen Technik und Klinik. Mich hat diese klinische Translation schon immer fasziniert, wie neue Technologien in die Klinik kommen.
Anna: Wir schätzen uns zudem sehr glücklich, mit Dr. Heinz Schwer einen so erfahrenen und engagierten Partner an unserer Seite zu haben, der uns mit über 20 Jahren Berufserfahrung in finanziellen und strategischen Fragestellungen mit herausragendem Engagement und Expertise begleitet. Unterstützt wird er von seinem Sohn Valentin Schwer, der frische Perspektiven und großes Engagement ins Projekt einbringt. Und mit Dr. Eric Wittchow haben wir einen Experten an Bord, der tiefes Know-how in der lokalen Arzneimittelabgabe und bioresorbierbaren Stents, sowie Regulatorik mitbringt – gerade für die präklinische Entwicklung ein großer Gewinn.
Wo habt ihr mit eurem starken Team neben dem Businessplan Wettbewerb Nordbayern bislang erfolgreich teilgenommen?
Anna: Unser erster kleiner Erfolg war der Posterpreis des Interdisziplinären Zentrums für Klinische Forschung (IZKF). Bereits in einer frühen Projektphase erhielten wir eine Förderung durch die Vogel-Stiftung Dr. Eckernkamp. Hier hat uns Dr. Gunther Schunk bereits in einer sehr frühen Projektphase nicht nur Mut gemacht, sondern auch ganz konkret geholfen, unser Projekt strukturiert und nachhaltig aufzubauen – dafür sind wir sehr dankbar. Zudem wurden wir mit dem Bätz-Preis des Universitätsbundes e.V. ausgezeichnet. Ein wichtiger Meilenstein war der Gewinn des Medical Valley Awards – mit einer Förderung in Höhe von 500.000 Euro durch das Bayerische Staatsministerium für Wirtschaft, Landesentwicklung und Energie. Darüber hinaus konnten wir beim Pitch Contest des Medical Valley e.V. wertvolle regulatorische Beratungsleistungen gewinnen. Eine besondere Auszeichnung war auch die Aufnahme in die innovate! Akademie sowie die damit verbundene Förderung durch die Joachim Herz Stiftung in Höhe von 250.000 Euro, mit der unter anderem die Stelle von Johannes finanziert wird. Beim Hochsprung-Award 2025 sicherten wir uns den zweiten Platz. Zuletzt wurden wir beim Würzburger StartUP-Preis der Initiative Gründen@Würzburg im Mainfranken Theater in der Kategorie „Global Hero“ sowohl durch das Jury-Votum als auch im Publikumsvoting mit dem ersten Platz ausgezeichnet. Ein herzlicher Dank gilt auch der Else Kröner-Fresenius-Stiftung, deren Forschungsfreistellung mir die nötige Flexibilität für die wissenschaftliche Weiterentwicklung des Projekts ermöglicht.
Johannes: Das Schöne ist, dass wir Auszeichnungen aus ganz unterschiedlichen Richtungen erhalten haben. Sowohl Vertreter und Vertreterinnen der Wissenschaft als auch der Wirtschaft signalisieren uns: Das, was wir vorhaben, ist sinnvoll und zukunftsweisend.
Bei den Wettbewerben ist Sommerpause. Dafür läuft die Arbeit im Labor auf Hochtouren. Welchen Herausforderungen müsst ihr euch hier derzeit stellen?
Johannes: Nachdem wir einen so genannten Proof im Concept zeigen konnten befinden wir uns derzeit im Technologie Reifegrad Level (TLR) 3. Jetzt erfolgt die Optimierung und die erweiterte technische Umsetzung für die klinische Translation. Wir arbeiten derzeit daran, das ENDOLEASE-System so weiterzuentwickeln, dass es minimalinvasiv über die Leiste eingebracht werden kann – also auf einen Katheter aufgebracht und im Zielgefäß entfaltet wird. Dafür müssen wir es „crimpen“, also auf ein sehr kleines Maß komprimieren. Ist es an der gewünschten Stelle angekommen, wird ein kleiner Ballon aufgeblasen, der das Implantat aufdehnt und es sanft an die Gefäßwand presst.
Das Einsetzen verläuft also wie bei einem Stent?
Johannes: Die Implantation ist vergleichbar, ja. Doch der Unterschied liegt in der Funktion: Ein klassischer Stent hält das Gefäß offen und gewährleistet einen freien Blutfluss. Inzwischen gibt es auch Drug-Eluting-Stents (DES), also mit Wirkstoffen beschichtete Stents. Die Wirkstoffe werden jedoch ausschließlich nach außen in die Gefäßwand abgegeben, um eine erneute Verengung der Gefäße zu verhindern.
Unser ENDOLEASE-System verfolgt einen anderen Ansatz: Es gibt die Wirkstoffe nicht in die Gefäßwand, sondern in den arteriellen Blutstrom ab, sodass wir damit nicht die Arterienwand, sondern ein bestimmtes Gewebeareal oder ein Organ behandeln können, je nachdem, welches Gewebe oder Organ beschädigt ist.
Dank des Hydrogelträgers können wir dort über definierte Zeiträume im Vergleich zu Drug-Eluting-Stents größere Mengen verschiedenster Wirkstoffklassen freisetzen – auch komplexe Substanzen wie Antikörper.
Welche Wirkstoffe könnten über das ENDOLEASE-System transportiert werden?
Anna: Tatsächlich erreichen uns aus der wissenschaftlichen Community immer wieder gezielte Anfragen zu potenziellen Anwendungen. Die Frage ist oft: Können wir dieses oder jenes Medikament mithilfe eines ENDOLEASE-Systems lokal in höherer Konzentration freisetzen – bei gleichzeitiger Reduktion systemischer Nebenwirkungen? Auch empfindliche Substanzen wie mRNA, Endonukleasen, siRNA oder Antisense-Oligonukleotide rücken zunehmend in den Fokus. Der Bedarf an präzisen, lokal wirksamen Wirkstoffabgabesystemen ist enorm – und wir würden uns sehr freuen, wenn wir mit ENDOLEASE einen Beitrag zur Lösung dieser Herausforderungen leisten könnten.
Eigentlich bräuchtet ihr ein riesengroßes Team, um alle Indikationen abzudecken. Ihr fokussiert euch zunächst jedoch auf die Behandlung von Herzinfarkten und die Vorbeugung von Herzinsuffizienz. Wie sieht hier der weitere Zeitplan aus?
Anna: Unser Ziel ist es, das ENDOLEASE-System bis Ende des Jahres erfolgreich im Kaninchenmodell zu testen. Danach wollen wir einen Ethikantrag für eine Großtierstudie einreichen. Ein Proof-of-Concept im Schweinemodell ist aus wissenschaftlicher Sicht ein wichtiger nächster Schritt, bevor wir in eine größere präklinische Kohorte gehen.
Johannes: Das Besondere an unserem Standort ist, dass es am Deutschen Zentrum für Herzinsuffizienz (DZHI) bereits etablierte Tiermodelle für Herzinfarkte gibt. Wir freuen uns, dass uns unser Kooperationspartner, Professor Ulrich Hofmann von der Medizinischen Klinik und Poliklinik I, die Möglichkeit eröffnet, dort die ENDOLEASE-Technologie unter realistischen Bedingungen zu erproben.
Johannes, du bist gerade dabei, deine naturwissenschaftliche Doktorarbeit über ein Herzpflaster abzuschließen. Kommt diese Expertise auch Endolease zugute?
Johannes: Ja, ich kann bei ENDOLEASE sehr gut auf meiner bisherigen Arbeit aufbauen. Wir verwenden nämlich das gleiche 3D-Druckverfahren, das sogenannte Melt Electrowriting, und Hydrogele. Im Rahmen meiner Doktorarbeit haben wir auch schon am Herzinfarktmodell gearbeitet.
Wie unterscheidet sich dein Herzpflaster von dem, was das Team um Prof. Wolfram-Hubertus Zimmermann in Göttingen erstmals am Menschen getestet hat?
Johannes: Die mechanische Architektur unseres Herzpflasters ist besonders. Es verfügt über bestimmte elastische Zonen, mit deren Hilfe es über die Herzoberfläche gestreckt werden kann, sowie über Kraftübertragungszonen. Über diese können die kontrahierenden Zellen des Pflasters ihre Kraft direkt auf den Herzmuskel übertragen um die Herzunterstützung weiter zu verbessern.
Ihr seid auf Tierversuche angewiesen, bevor das System am Menschen getestet wird. Gleichzeitig arbeitet ihr nach dem 3R-Prinzip (Replace, Reduce, Refine). Gibt es hier konkrete Pläne, wie ihr Tierversuche vermeiden, vermindern und verbessern könnt?
Anna: Es ist uns ein großes Anliegen, Tierversuche zu reduzieren – sowohl aus ethischer als auch aus wissenschaftlich-strategischer Perspektive. Wir planen aktuell die Entwicklung eines digitalen Zwillings, der präklinische Daten integriert und Simulationen ermöglicht. Das heißt, der Computer lernt aus den Daten und kann genau voraussagen, wie das System reagiert, wenn wir eine bestimmte Variable ändern.
Dieses System soll nicht nur Tierversuche reduzieren, sondern langfristig auch als Entscheidungsunterstützung für Implantatdesign, Platzierung, Dosisanpassung und Wirkstoffwahl dienen.
Wer stand bzw. steht euch noch aus Würzburg zur Seite?
Anna: Dr. Gerhard Frank vom Innovations- und Gründerzentrum Würzburg (IGZ) hat von Anfang an uns geglaubt und uns mit großer Expertise, Weitblick und echtem persönlichen Einsatz begleitet. Besonders wertvoll war auch seine Unterstützung bei der Vernetzung mit Schlüsselpersonen, darunter der wunderbare Aktivsenior Wolfgang Beyer, der uns mit seiner langjährigen unternehmerischen Erfahrung zur richtigen Zeit zahlreiche kluge und praxisnahe Impulse gegeben hat. Auch das Servicezentrum Forschung und Technologietransfer (SFT) der Universität Würzburg unter der Leitung von Dr. Iris Zwirner-Baier, begleitet uns hervorragend bei unseren Patentanmeldungen und strategischen Fragen des Technologietransfers.
Absolut bereichernd war zudem die Unterstützung durch Prof. Dr. Wolfram Voelker und Sabine Franzek vom Interdisziplinären Trainings- und Simulationszentrum (INTUS), die uns wichtige Ressourcen zur Verfügung gestellt und bei einem wichtigen Besuch die Implantation des ENDOLEASE-Systems in einer realitätsnahen Simulation demonstriert haben.
Einen zentralen Baustein zur präklinischen Sicherheitsbewertung unseres Implantats liefert auch Dr. Maria Drayß, Clinician Scientist mit kardiologischer Expertise. Sie führt am Rudolf-Virchow-Zentrum (RVZ) unter der Leitung von Prof. Dr. Harald Schulze gezielt Thrombogenitätstestungen der ENDOLEASE-Systeme durch. Nicht zuletzt möchten wir Prof. Laura Schreiber, Rebekka Grapp und dem gesamten Team der Versuchstierhaltung danken sowie Dr. Niklas Beyersdorf vom Institut für Virologie und Immunbiologie, dessen Einsatz für den reibungslosen Ablauf unserer präklinischen Studien von unschätzbarem Wert war. Auch Prof. Dr. Lorenz Meinel vom Institut für Pharmazie und Lebensmittelchemie gilt unser Dank, der uns als Mentor mit seiner pharmakologischen Expertise durch entscheidende Projektphasen getragen hat.
Natürlich wäre das Projekt ohne die Unterstützung vieler weiterer Personen nicht denkbar. Und dafür sind wir sehr dankbar.
Das Interview führte Kirstin Linkamp (Wissenschaftskommunikation am UKW)