Würzburg. Zehn bis 20 Prozent der über 70-Jährigen in Europa leiden an Herzinsuffizienz, auch Herzschwäche genannt. Entweder pumpt ihr Herz nicht mehr stark genug oder es füllt sich nicht richtig. Bei einer Herzinsuffizienz mit reduzierter Pumpfunktion (HFrEF, Heart Failure with reduced Ejection Fraction) liegt in der Regel eine direkte Schädigung des Herzens vor, beispielsweise durch einen Herzinfarkt. Im Gegensatz dazu wird die Herzinsuffizienz mit erhaltener Pumpfunktion, kurz HFpEF (Heart Failure with preserved Ejection Fraction), häufig durch nicht herzspezifische Begleiterkrankungen wie Adipositas, Bluthochdruck und Niereninsuffizienz verursacht. Aber auch Diabetes ist ein wichtiger Risikofaktor. Umgekehrt kann Herzinsuffizienz Diabetes, Niereninsuffizienz und andere Erkrankungen begünstigen.
COST Action EU-METAHEART: EUropean network to tackle METAbolic alterations in HEART failure
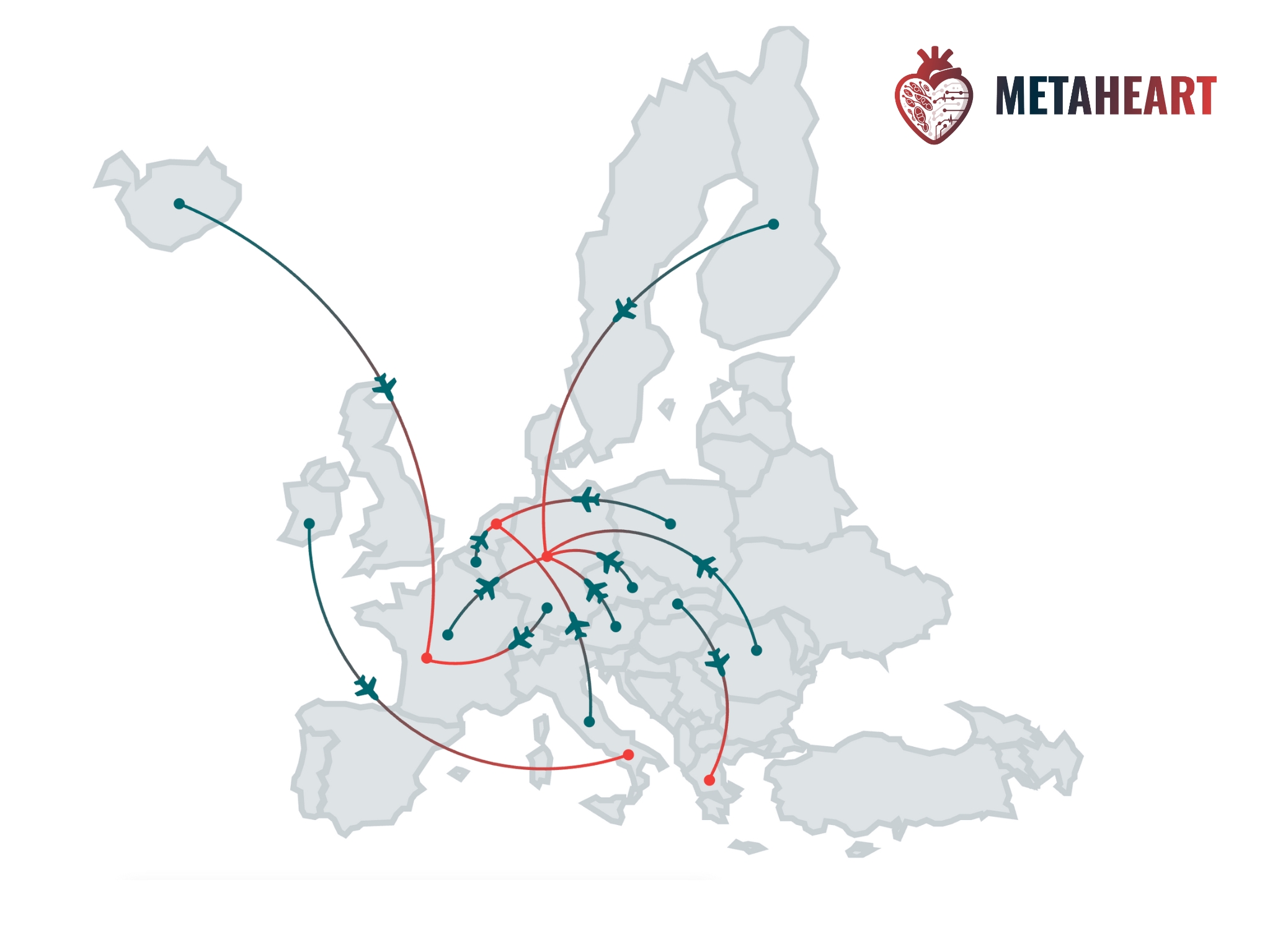
Deshalb wird die Herzinsuffizienz inzwischen nicht mehr als isolierte Organerkrankung, sondern als Systemerkrankung des gesamten Körpers betrachtet. Das Herz steht in ständigem Austausch mit anderen Organen, beispielsweise über Hormone, Entzündungsprozesse und den Stoffwechsel. Der Stoffwechsel, auch Metabolismus genannt, umfasst insbesondere die Umwandlung von Nahrungsstoffen wie Zucker, Fetten und Aminosäuren in zelluläre Energie in den Mitochondrien, den Kraftwerken der Zellen. Genau diese metabolischen Veränderungen bei Herzschwäche stehen im Forschungsfokus des Europäischen Netzwerks EU-METAHEART (EUropean network to tackle METAbolic alterations in HEART failure). METAHEART ist eine sogenannte COST Action (CA22169), die am 18. Oktober 2023 in Brüssel ihren Kick-off hatte und vier Jahre lang gefördert wird. COST steht für „European Cooperation in Science and Technology“, und Action für das geförderte Forschungsnetzwerk, in dem Wissenschaftlerinnen und Wissenschaftler aus mehr als 40 Ländern und mit unterschiedlichen Karrierestufen zu einem gemeinsamen Thema zusammenarbeiten.
Sonderausgabe von Nature Reviews Cardiology zu Stoffwechselveränderungen bei Herzinsuffizienz
Einen Überblick über die vier Forschungsschwerpunkte von METAHEART (Zellstoffwechsel im Herzmuskel, Stoffwechselveränderungen auf die Blutgefäße, Immunmetabolismus, Mechano-Energetik bei Herzinsuffizienz) liefert die aktuelle Sonderausgabe der renommierten kardiologischen Fachzeitschrift „Nature Reviews Cardiology“ zum Thema Stoffwechselveränderungen bei Herzinsuffizienz. Sie erschien im Rahmen des Kongresses der Society for Heart and Vascular Metabolism, der vom 22. bis 25. Juni in Bordeaux stattfand. Das Editorial schrieb Prof. Dr. Christoph Maack, Initiator von EU-METAHEART und Sprecher des Deutschen Zentrums für Herzinsuffizienz Würzburg (DZHI), an dem er die Translationale Forschung leitet. Neben Maack sind eine Reihe weiterer Wissenschaftlerinnen und Wissenschaftler sowie Klinikerinnen und Kliniker aus der Universitätsmedizin Würzburg an dem Netzwerk beteiligt.
Mechano-Energetik: Wenn Pumpfunktion und Energieversorgung aus dem Gleichgewicht geraten
Maacks Forschungsschwerpunkt ist die Mechano-Energetik bei Herzinsuffizienz, die in der vierten Arbeitsgruppe von METAHEART abgebildet wird. Im gesunden Herzen ist die Energieversorgung eng an den ständig wechselnden Bedarf angepasst. Bei Herzinsuffizienz kommt es jedoch zu einem Missverhältnis zwischen Energieversorgung und -bedarf. „Während dies bei Herzschwäche mit reduzierter Pumpfunktion vor allem auf eine verringerte Energieversorgung aufgrund von Defekten der Mitochondrien zurückzuführen ist, wird bei Herzschwäche mit erhaltener Pumpfunktion das anfangs noch gut funktionierende Herz mechanisch überlastet, beispielsweise durch hohen Blutdruck oder Übergewicht. In beiden Krankheitsbildern kommt es durch dieses Missverhältnis zu oxidativem Stress, der das Herz wiederum langfristig schädigt“, erklärt Christoph Maack. Klassische Medikamente wie ACE-Hemmer, Betablocker oder sogenannte ARNI helfen vor allem bei eingeschränkter Pumpfunktion. Bei erhaltener Pumpfunktion wirken sie dagegen weniger gut. Maack ergänzt: „Diese Form der Herzschwäche ist derzeit eine unserer größten therapeutischen Herausforderungen.“
Therapieansätze, die schädlichen Sauerstoffstress in Herzmuskelzellen hemmen
Es gibt jedoch neue Therapieansätze, die gezielt am Stoffwechsel ansetzen und sich auch positiv auf Herzschwäche mit erhaltener Pumpfunktion auswirken. Dazu zählen beispielsweise SGLT-2-Hemmer und GLP-1-Rezeptor-Agonisten, die ursprünglich für die Behandlung von Diabetes entwickelt wurden. Diese positiven Effekte hängen vermutlich mit einer besseren Energieverwertung im Körper und im Herzen zusammen. Auch bei der Mechano-Energetik spielen die Mitochondrien eine wichtige Rolle. Sind diese energetisch überlastet oder arbeiten im weiteren Verlauf nicht mehr richtig, entstehen vermehrt reaktive Sauerstoffspezies (ROS). Diese stören die elektrische Steuerung und das Zusammenziehen des Herzens, also die elektromechanische Kopplung. Zudem werden schädliche Signalwege aktiviert, die zu Umbauprozessen des Herzens führen und dessen Struktur und Funktion weiter verschlechtern. In Tierversuchen zeigen neue Therapieansätze, die oxidativen Stress in den Zellen hemmen, vielversprechende Ergebnisse. In der Praxis sind diese Therapien allerdings noch nicht angekommen.
„Trotz bedeutender Fortschritte in der Forschung übersteigt die Komplexität des Stoffwechsels und die wechselseitige Abhängigkeit regulatorischer Mechanismen häufig die Möglichkeiten einzelner Disziplinen und Institutionen. Daher sind Konsortien wie METAHEART so wichtig, in denen Forschungsinitiativen in ganz Europa vernetzt werden“, betont Christoph Maack.
Einfluss von Stoffwechselveränderungen auf Blutgefäße, Zellstoffwechsel im Herzmuskel und Immunmetabolismus
Die Arbeitsgruppe „Vaskuläre (Dys-)Funktion“, der auch einige Mitglieder der früheren COST Action EU-CARDIOPROTECTION (CA16225) angehören, analysiert den Einfluss von Stoffwechselveränderungen auf die Blutgefäße. Während es bei HFrEF aufgrund von Verengungen oder Verschlüssen oft in den großen Herzkranzgefäßen zu Durchblutungsstörungen kommt, ist bei HFpEF eher die Durchblutung in den kleinen Gefäßen des Herzmuskels gestört. In beiden Fällen bekommt der Herzmuskel zu wenig Blut und Sauerstoff und kann nicht mehr richtig arbeiten. Umgekehrt kann eine Herzschwäche die Durchblutung des Herzens verschlechtern – ein Teufelskreis.
Eine weitere Arbeitsgruppe untersucht, ob und wie Zwischenprodukte des Stoffwechsels die Herzmuskelzellen zusätzlich belastet. Metabolische Zwischenprodukte stehen im Verdacht, die Funktion wichtiger Eiweiße im Herzmuskel zu verändern und den Transport und Austausch von elektrisch geladenen Teilchen - sogenannten Ionen - wie zum Beispiel Kalzium, Natrium und Kalium in und aus den Herzmuskelzellen sowie die Energieübertragung zu stören. Dies erhöht den oxidativen Stress und schwächt das Herz langfristig. In der dritten Arbeitsgruppe, der Arbeitsgruppe „Immunmetabolismus“, steht das Zusammenspiel zwischen Stoffwechselveränderungen und Entzündungsprozessen im Vordergrund. Ist das Herz gestresst, reagiert das Immunsystem. Abwehrzellen wandern in den Herzmuskel ein und können, je nach Stoffwechsel, Entzündungen fördern oder hemmen. Diese Interaktionen zwischen Herz und Immunsystem werden auch im Sonderforschungsbereich SFB 1525 (Sprecher: Prof. Dr. Stefan Frantz) am Universitätsklinikum Würzburg intensiv erforscht.
Zukunftsfähigkeit des gesamteuropäischen Wissenschaftsraums stärken
Insgesamt sind Forscherinnen und Forscher aus 43 Ländern an METAHEART beteiligt, darunter 22 sogenannte ITCs. ITC steht für „Inclusiveness Target Countries“. Diese Länder gehören im Hinblick auf Forschung und Entwicklung zu den strukturschwächeren in Europa. Damit alle gleichermaßen vom wissenschaftlichen Austausch profitieren, müssen bei jeder COST Action mindestens 50 Prozent der beteiligten Länder ITCs sein. Ebenso ausgewogen sollte die Vertretung von Frauen und Männern in den Forschungsnetzwerken und Führungspositionen sein. Ein weiterer wichtiger Punkt der COST Actions ist die Förderung junger Wissenschaftlerinnen und Wissenschaftler, den sogenannten YRI, was für Young Researchers and Innovators steht. Damit soll der Wissenstransfer gesichert und die Zukunftsfähigkeit des gesamteuropäischen Wissenschaftsraums gestärkt werden.
Short-Term Scientific Missions (STSM)
Eine wichtige und beliebte Maßnahme der COST Actions sind die Kurzzeit-Forschungsaufenthalte, sogenannte Short-Term Scientific Missions (STSM). „Je nach wissenschaftlicher Fragestellung, Versuchsanordnung und Budget können unsere YRIs für einige Wochen ein wissenschaftliches Praktikum in einem anderen Labor absolvieren“, berichtet STSM-Koordinatorin Prof. Dr. Katrin Streckfuß-Bömeke. Die Professorin für Molekulare Pharmakologie am Institut für Pharmakologie und Toxikologie der Julius-Maximilians-Universität Würzburg ist Expertin für Erkrankungen des Herzmuskels, sogenannte Kardiomyopathien (siehe PM). Durch die STSM findet laut Streckfuß-Bömeke ein großer wissenschaftlicher Austausch innerhalb Europas statt. Ziel ist, dass jede Mission zu einer nachhaltigen Zusammenarbeit zwischen zwei Arbeitsgruppen führt. Es müsse ja kein riesiges Projekt sein, aber eine gemeinsam erarbeitete Abbildung in einem Paper oder ein gemeinsames Review seien schon toll, vor allem, wenn es von YRIs aus einem Eingliederungszielland kommt.
Drei Tage Training School und zwei Tage Konferenz in Würzburg
Neben den STSM profitieren die jungen Forschenden auch von Konferenzen, Workshops und Trainings. So fand im September 2024 in Würzburg eine dreitägige Training School mit 24 jungen Talenten aus verschiedenen Ländern statt, an die sich eine zweitägige Konferenz anschloss. Die Teams von Christoph Maack und Katrin Streckfuß-Bömeke gaben den YRIs in den Laboren des DZHI Kurse zu den Methoden Ionoptix, Oroboros und Seahorse, die sowohl theoretische als auch praktische Inhalte umfassten. Dabei wurden sie von Vertretern der Gerätefirmen unterstützt, die eigens dafür angereist waren. Zusätzlich wurden Mentoring-Vorträge und -Gespräche für die jungen Wissenschaftlerinnen und Wissenschaftler angeboten.
„In Europa gibt es viele exzellente Wissenschaftlerinnen und Wissenschaftler auf dem Gebiet Metabolismus und Herzinsuffizienz. Aber die Fäden laufen oft in Würzburg zusammen. Die Kombination verschiedener Techniken auf dem Gebiet des Metabolismus ist hier einzigartig“, so Katrin Streckfuß-Bömeke, die bis 2021 in Göttingen geforscht hat. „Wir arbeiten mit Humangewebe, Mausgewebe und humanen Stammzellmodellen. Viele Länder haben nicht die Möglichkeit, all diese Modellsysteme und humanen Ressourcen zu nutzen.“
Die COST Action EU-METAHEART wird mit über 200.000 Euro pro Jahr für die genannten Netzwerkaktivitäten gefördert. Für ihr Engagement als Mitglieder des sogenannten Management Committee (MC) erhalten Streckfuß-Bömeke und Maack selbst keine direkten Fördergelder. Ihre Arbeit ist jedoch eine Investition in die Zukunft. So werden Kooperationspartner gefunden und neue Anträge für gemeinsame Projekte eingereicht. „Dieses Niveau, das in so kurzer Zeit erreicht wurde, und der Spirit, mit dem die Leute interagieren, habe ich so noch nie gesehen“, freut sich Katrin Streckfuß-Bömeke. Christoph Maack ergänzt: „Mit EU-METAHEART ist eine ganz neue Community entstanden. Man spürt förmlich, wie die Wissenschaftlerinnen und Wissenschaftler für die Themen Metabolismus und Herzinsuffizienz brennen. Jetzt haben sie endlich eine Plattform, auf der sie gemeinsam viel bewegen können.“
Text: KL / Wissenschaftskommunikation