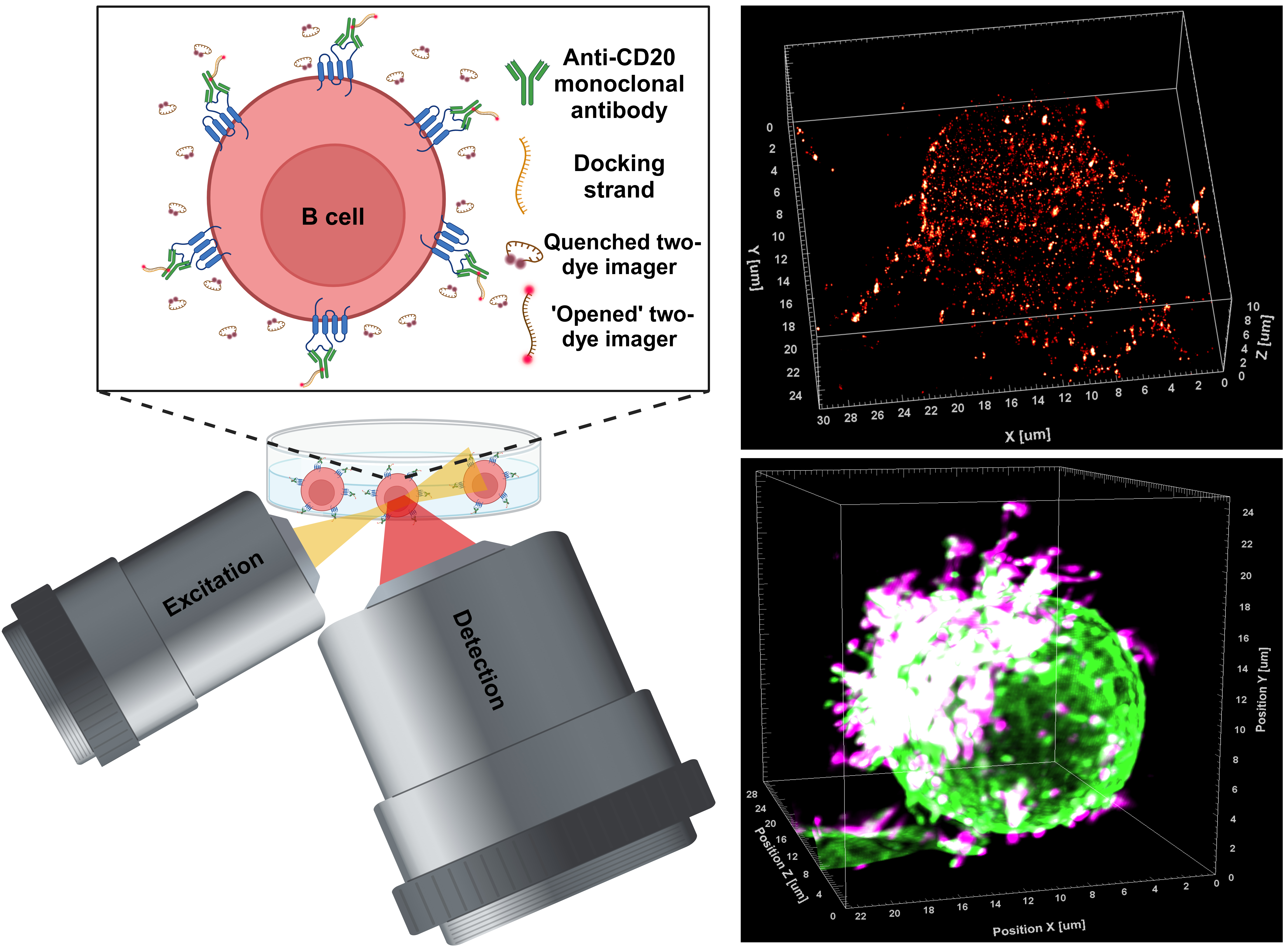
Bei Blutkrebserkrankungen wie der chronischen lymphatischen Leukämie sind es B-Zellen des Immunsystems, die sich unkontrolliert vermehren. Eine Therapieform besteht darin, das Protein CD20 auf der Oberfläche der B-Zellen mit maßgeschneiderten Antikörpern zu markieren. Das löst eine Kette immunologischer Reaktionen aus und führt am Ende zur Zerstörung der Krebszellen.
Solche immuntherapeutischen Antikörper werden seit 30 Jahren gegen Tumorerkrankungen eingesetzt. „Obwohl es für den Therapieerfolg von entscheidender Bedeutung ist, wissen wir bis heute nur sehr wenige Details darüber, wie die Antikörper an CD20 binden und wie die folgenden Reaktionen ablaufen“, sagt Professor Markus Sauer vom Biozentrum der Julius-Maximilians-Universität (JMU) Würzburg.
Der Effektivität der Antikörper auf der Spur
Das dürfte sich nun ändern: Ein Team um den JMU-Biophysiker hat eine neue superauflösende mikroskopische Methode entwickelt. Sie macht es erstmals möglich, die Wechselwirkungen der therapeutischen Antikörper mit Zielmolekülen auf Tumorzellen in 3D mit molekularer Auflösung zu untersuchen.
„Wir können nun beobachten, wie effektiv die Antikörper arbeiten und damit zur Entwicklung verbesserter Therapien beitragen“, so Markus Sauer.
Die neue mikroskopische Methode heißt LLS-TDI-DNA-PAINT. Im Wissenschaftsjournal Science beschreiben Erstautor Dr. Arindam Ghosh und ein Team aus dem Lehrstuhl von Markus Sauer, wie die neu entwickelte Technologie funktioniert und welche Erkenntnisse damit bereits gewonnen wurden. An der Studie waren auch Dr. Thomas Nerreter und Professor Martin Kortüm von der Medizinischen Klinik II des Würzburger Universitätsklinikums beteiligt.
B-Zellen nehmen die Gestalt eines Igels an
Das Würzburger Forschungsteam hat die ersten Studien mit der neuen Mikroskopie-Methode an fixierten und lebenden Raji-B-Zellen durchgeführt. Diese Zelllinie stammt aus dem Burkitt-Lymphom eines Patienten und wird in der Krebsforschung oft eingesetzt. Die Forscher brachten sie mit jeweils einem der vier therapeutischen Antikörper RTX, OFA, OBZ und 2H7 in Kontakt.
Alle vier Antikörper verketten die CD20-Moleküle in der Zellmembran, so dass lokal starke Anhäufungen entstehen. Das aktiviert das sogenannte Komplementsystem und leitet das Abtöten der Zellen durch das Immunsystem ein. Im Gegensatz zur derzeitigen Klassifizierung therapeutischer Antikörper zeigen die Ergebnisse, dass die Verkettung der CD20-Moleküle unabhängig davon eintritt, ob die Antikörper dem Typ I oder II angehören.
Die Experimente zeigen auch, dass alle vier Antikörper verstärkt CD20-Moleküle verketten, die sich an speziellen Orten der Membran befinden – und zwar auf mikrometerlangen Ausstülpungen der Membran, „Mikrovilli“ genannt. Gleichzeitig polarisiert das Binden der therapeutischen Antikörper die B-Zelle und die ausgestreckten Mikrovilli werden stabilisiert. Dadurch nehmen die B-Zellen eine Art Igelgestalt an, weil sich die Membranausstülpungen nur auf einer Seite der Zelle befinden.
Was als nächstes passiert
Was sich daraus ergibt? „Die bisherige Klassifizierung der therapeutischen Antikörper in die Typen I und II kann nicht weiter aufrechterhalten werden“, sagt Dr. Arindam Ghosh. Bislang ging die Forschung davon aus, dass therapeutische Antikörper vom Typ I einen anderen Wirkungsmechanismus haben als die vom Typ II. Die Würzburger Studien aber widerlegen das.
„Durch die Igelgestalt erscheinen die B-Zellen, als ob sie eine immunologische Synapse mit einer anderen Zelle bilden wollten“, so der JMU-Forscher. Es sei vorstellbar, dass die behandelten B-Zellen auf diese Weise die Makrophagen und natürlichen Killerzellen des Immunsystems aktivieren. Ob diese Vermutung stimmt, will das Forschungsteam nun in weiteren Studien klären.
Publikation
Arindam Ghosh, Mara Meub, Dominic A. Helmerich, Julia Weingart, Patrick Eiring, Thomas Nerreter, K. Martin Kortüm, Sören Doose, and Markus Sauer. Decoding the molecular interplay of CD20 and therapeutic antibodies with fast volumetric nanoscopy.Science387,eadq4510(2025).DOI:10.1126/science.adq4510, https://doi.org/10.1126/science.adq4510
Kontakt
Prof. Dr. Markus Sauer, Lehrstuhl für Biotechnologie und Biophysik, Biozentrum der Universität Würzburg, und Rudolf Virchow Center, Research Center for Integrative and Translational Bioimaging, Universität Würzburg, markus.sauer@uni-wuerzburg.de
Förderer
Diese Arbeiten wurden gefördert vom European Research Council, dem Bundesministerium für Bildung und Forschung und der Deutschen Forschungsgemeinschaft.
Pressemitteilung der Universität Würzburg vom 10. Januar 2025