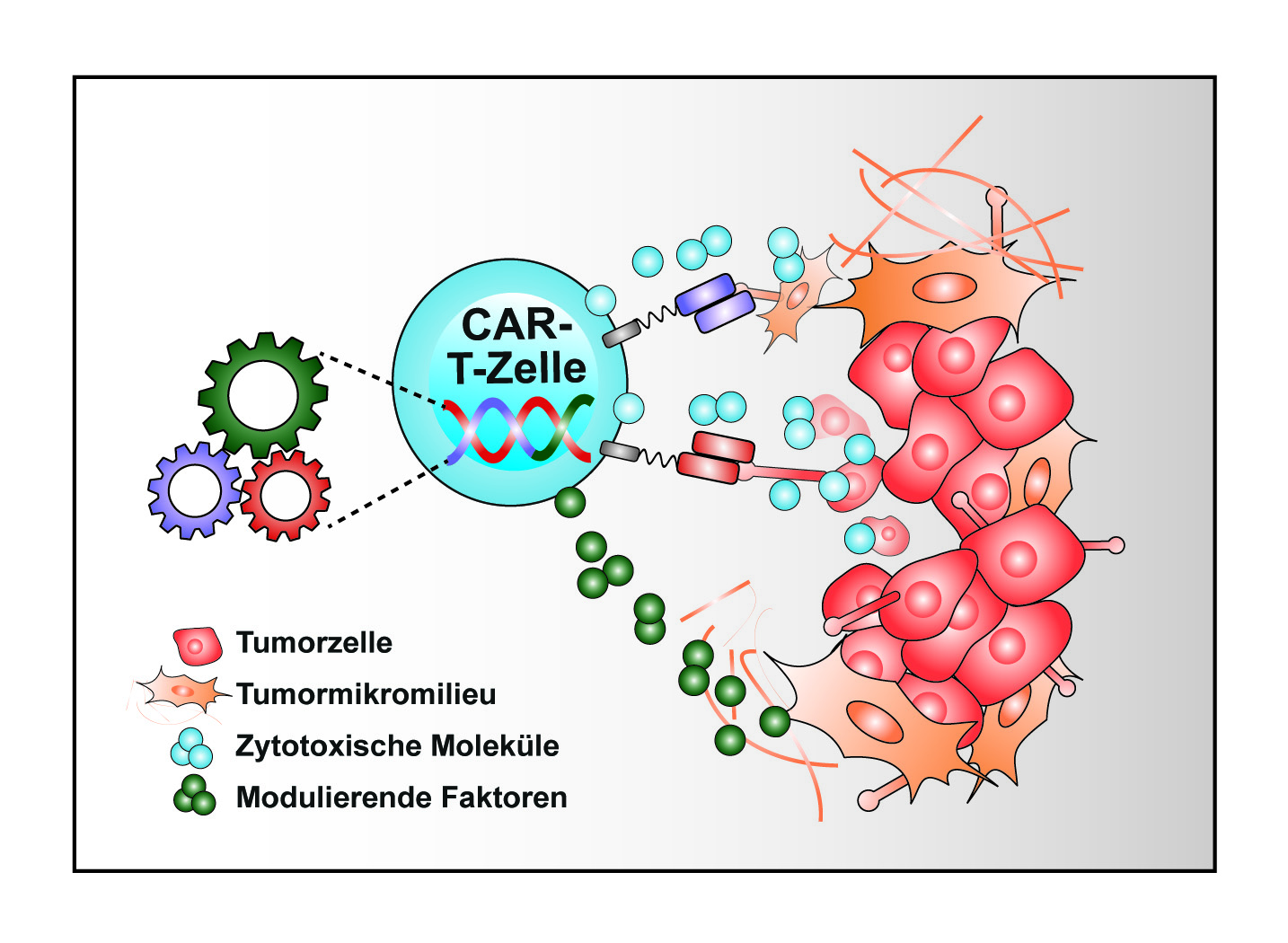
Würzburg. Im Rahmen der klinischen Phase I-Studie LION-1 wurde der erste Patient mit dem neu entwickelten Medikament behandelt. Bis zu 46 Patientinnen und Patienten erhalten im Verlauf der Studie modifizierte Immunzellen (T-Zellen), die gezielt gegen das Protein ROR1 gerichtet sind, welches bei verschiedenen Krebsarten auf den Tumorzellen vorkommt. So ausgerüstet sollen die T-Zellen die Tumorzellen erkennen und bekämpfen.
Umgesetzt wird die Studie am neu entstandenen Clinical Trial Center des NCT WERA, das an die von Dr. Maria-Elisabeth Goebeler geleitete Early Clinical Trial Unit (ECTU) angegliedert ist. Das Studienteam ist für die aufwändige Durchführung der Studie verantwortlich und koordiniert die beteiligten Fachbereiche, aus denen die Patientinnen und Patienten zugewiesen werden. Studienleiter der LION-1-Studie ist Prof. Dr. Hermann Einsele, Direktor der Medizinischen Klinik II am UKW und Sprecher des NCT WERA.
Das Nationale Centrum für Tumorerkrankungen (NCT) ist eine langfristig angelegte Kooperation zwischen dem Deutschen Krebsforschungszentrum (DKFZ), exzellenten Partnern in der Universitätsmedizin und weiteren herausragenden Forschungspartnern an verschiedenen Standorten in Deutschland.
Weltweit erste CAR-T-Zell-Studie bei Nebennierenkarzinom
Bereits im Vorfeld waren dem ersten Patienten körpereigene T-Zellen entnommen worden, die dann im Labor des Fraunhofer-Instituts für Zelltherapie und Immunologie (IZI) in Leipzig mit dem sogenannten CAR-Rezeptor (chimärer Antigenrezeptor) ausgestattet wurden. Nun startet die Behandlung: Die umprogrammierten Immunzellen werden per Infusion zurück in den Blutkreislauf gebracht. Dort sollen die ROR1-CAR-T-Zellen die Krebszellen erkennen und zerstören. Der Patient ist an einem Nebennierenkarzinom erkrankt und die aktuellen Standardtherapien wurden bereits ausgeschöpft. „Das ist die weltweit erste CAR-T-Zell-Studie bei dieser seltenen bösartigen Entartung der Nebenniere“, beschreibt der behandelnde Endokrinologe Prof. Dr. Martin Fassnacht.
LION-1-Studie soll die Verträglichkeit der Behandlung abstecken
Prof. Dr. Sophia Danhof ist Fachärztin für Innere Medizin und Professorin für Zelluläre Immuntherapie von malignen Erkrankungen. Sie leitet die Behandlung und beschreibt die Erwartungen an die Studie: „Wir wollen wissen, wie der Körper die neue Behandlung verträgt. Welche Nebenwirkungen können auftreten, und welche Dosis ist die richtige? Gleichzeitig hoffen wir auf erste, wenn auch vorsichtige Anzeichen, dass die Therapie wirkt. Das können beispielsweise Rückgänge im Tumorwachstum, eine Verbesserung des Gesundheitszustands oder messbare Reaktionen im Immunsystem sein.“
Innerhalb der Studie werden zwei Patientengruppen untersucht – eine Gruppe mit Patientinnen und Patienten, die an Blutkrebserkrankungen wie Mantelzelllymphom oder chronischer lymphatischer Leukämie leiden, und eine Gruppe mit Patientinnen und Patienten, die an soliden Tumoren wie Eierstock-, Brust- oder Nebennierenrindenkrebs leiden. Insgesamt sind bis zu 23 Patientinnen und Patienten pro Gruppe geplant. „Um diese Anzahl zu erreichen, werden neben Würzburg weitere Standorte miteinbezogen,“ so Prof. Danhof. Das heißt: Nach den ersten so genannten Sentinel-Teilnehmern für die Dosis-Eskalation werden in den nächsten Schritten die NCT-Standorte Berlin und Köln im Rahmen von LION-1 rekrutieren. Die Standorte Erlangen, Regensburg und Augsburg weisen ihre Patientinnen und Patienten innerhalb der WERA-Allianz Würzburg zu.
ROR1 ist ein vielversprechendes Ziel auch für schwer behandelbare Tumoren
Die Etablierung einer Therapie mit ROR1-CAR-T Zellen wäre ein Meilenstein, da davon auch Krebserkrankte mit soliden Tumoren profitieren könnten. Diese sind mit einer derartigen Immuntherapie bislang kaum behandelbar.
Prof. Michael Hudecek, Sponsorvertreter der Studie, erklärt: „ROR1 ist ein vielversprechendes Ziel, weil es auf vielen Tumorzellen vorkommt, aber selten in gesunden Geweben.“ Das Forschungsteam seines Lehrstuhls für Zelluläre Immuntherapie des Uniklinikums hat die ROR1-spezifischen CAR-T-Zellen konstruiert.
Routinierter Partner für die patientenindividuelle Herstellung
Die Herstellung der klinischen Prüfpräparate für die LION-1-Studie erfolgt am Fraunhofer-Institut für Zelltherapie und Immunologie in Leipzig nach dem pharmazeutischen Standard der Guten Herstellungspraxis (GMP – Good Manufacturing Practice). Das Fraunhofer IZI verfügt über umfassende Erfahrungen mit der Herstellung von CAR-T-Zelltherapeutika und war bereits an der präklinischen Entwicklung der ROR-1-Therapie beteiligt.
In den modernen Reinräumen der Abteilung „GMP Zell- und Gentherapie“ werden zunächst spezifische Immunzellen des Patienten isoliert und angereichert. Anschließend wird die genetische Information für den neuartigen CAR-Rezeptor stabil in das Genom der T-Zellen integriert. Die Zellen werden dann über mehrere Tage hinweg vermehrt. Im Gegensatz zu allen bislang zugelassenen CAR-T-Zelltherapien, kommt dabei die virusfreie Sleeping-Beauty-Transposon-Technologie zum Einsatz.
Nach umfassenden Qualitätsanalysen und der pharmazeutischen Freigabe wird das Präparat zum Prüfstandort zurückgesendet, wo die Behandlung erfolgen kann. Die Herstellung der CAR-T-Zellen für den zweiten Patienten ist bereits abgeschlossen, sodass die Behandlung zeitnah erfolgen kann.
Text: Christina Bornschein / Lehrstuhl für Zelluläre Immuntherapie
Mehr zur Studie: Mit LION-1 startet erste NCT WERA-Brückenstudie
Das Nationale Centrum für Tumorerkrankungen (NCT)
Das NCT ist eine langfristig angelegte Kooperation zwischen dem Deutschen Krebsforschungszentrum (DKFZ), exzellenten Partnern in der Universitätsmedizin und weiteren herausragenden Forschungspartnern an verschiedenen Standorten in Deutschland: Berlin, Dresden, Heidelberg, SüdWest (Tübingen-Stuttgart/Ulm), WERA (Würzburg mit den Partnern Erlangen, Regensburg und Augsburg) und West (Essen/Köln). Der NCT Ausbau im Jahr 2023 von den ursprünglich zwei Standorten Heidelberg und Dresden auf sechs Standorte wurde durch das Bundesministerium für Bildung und Forschung im Rahmen der Nationalen Dekade gegen Krebs angetrieben und durch die Bundesländer Baden-Württemberg, Bayern, Berlin, Nordrhein-Westfalen und Sachsen unterstützt. Ziel des NCT ist, Innovationen in der Krebsforschung in Deutschland zielgerichtet und schnell in Studien zu überführen, um Krebs nach neuestem Stand der Forschung erfolgreich zu diagnostizieren und unter Beibehaltung einer hohen Lebensqualität zu behandeln. Patientinnen und Patienten sind dabei Forschungspartner auf Augenhöhe.