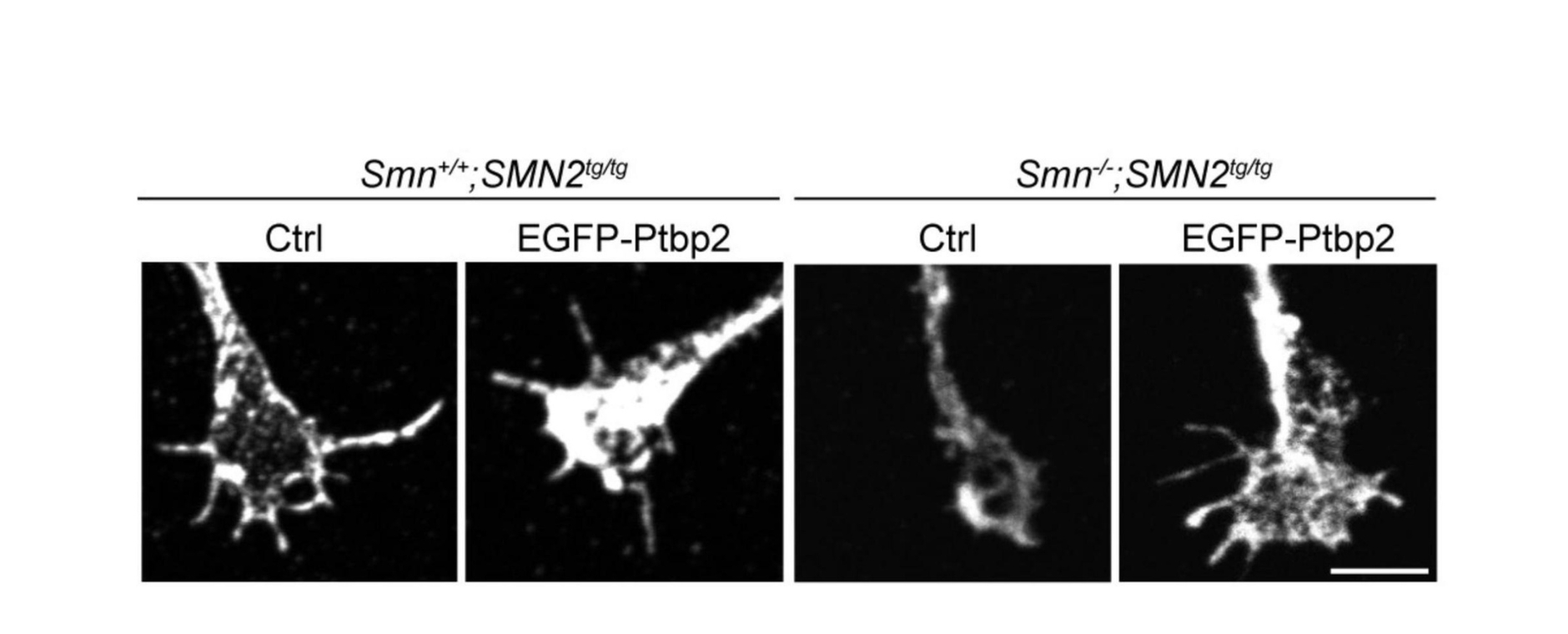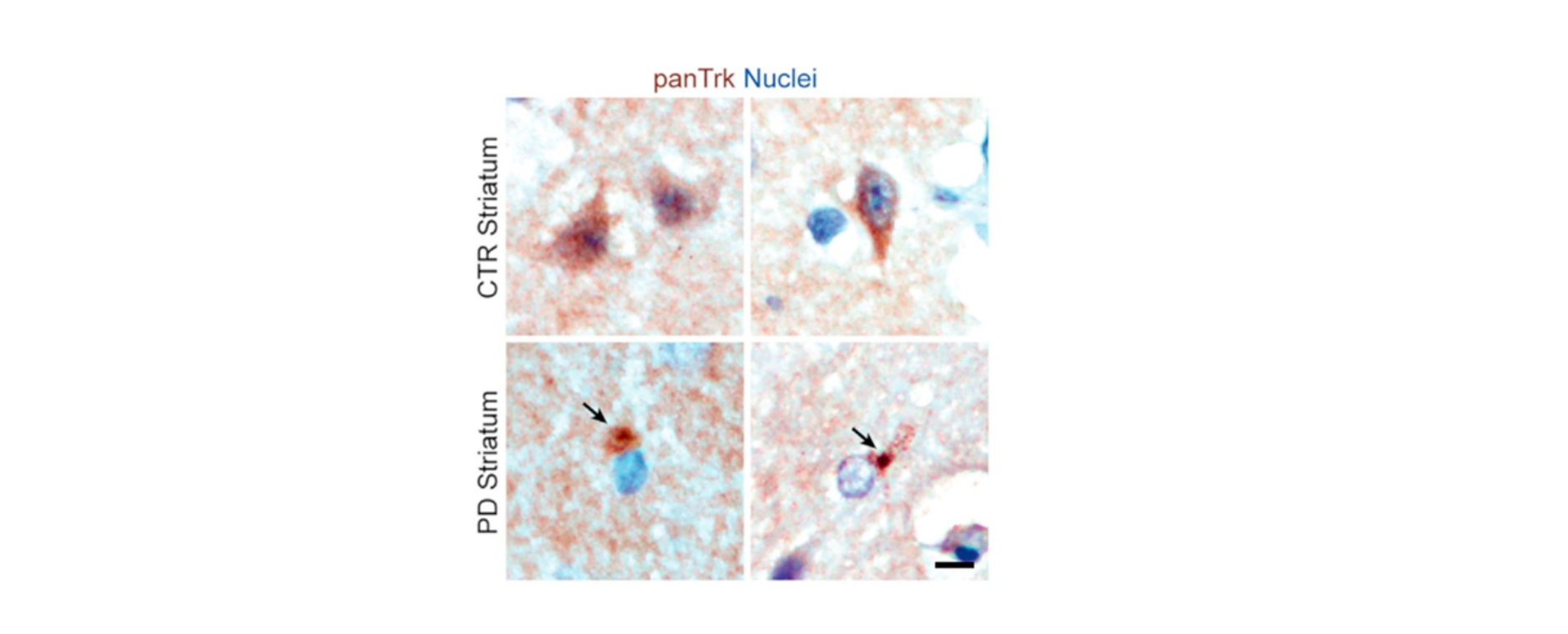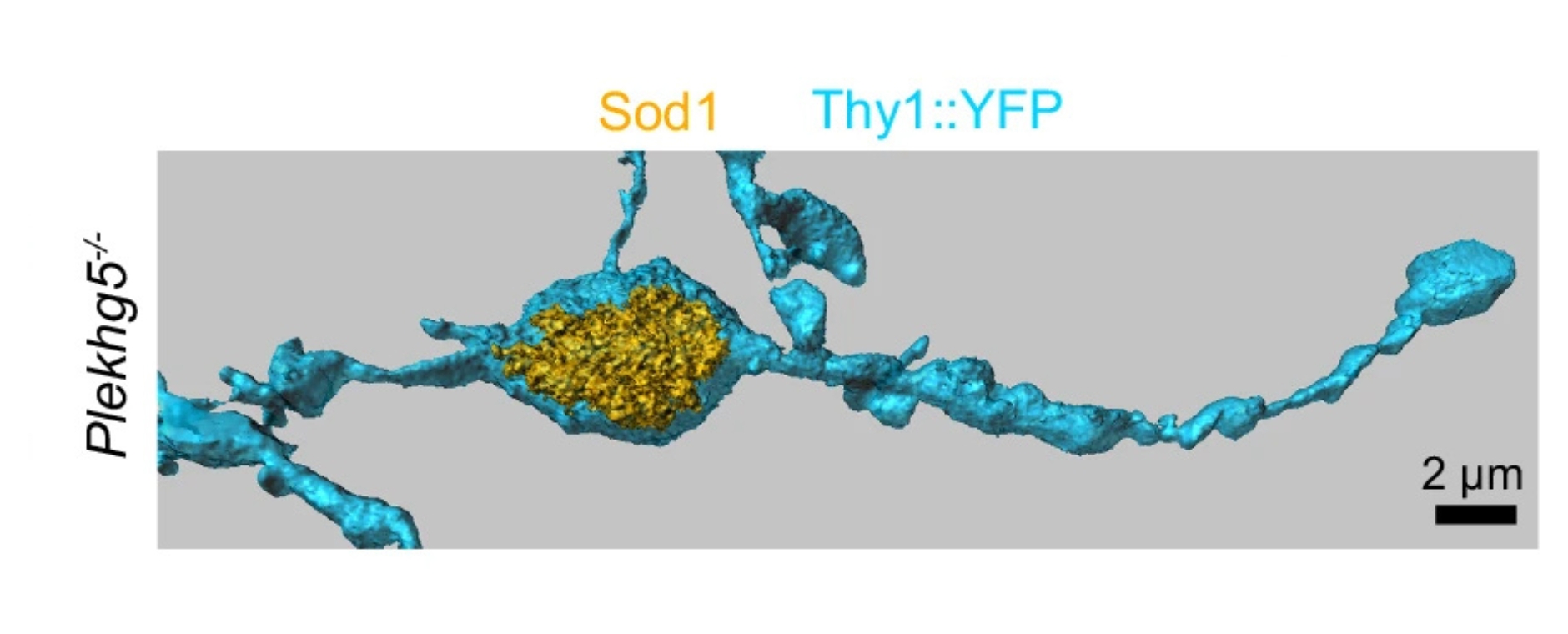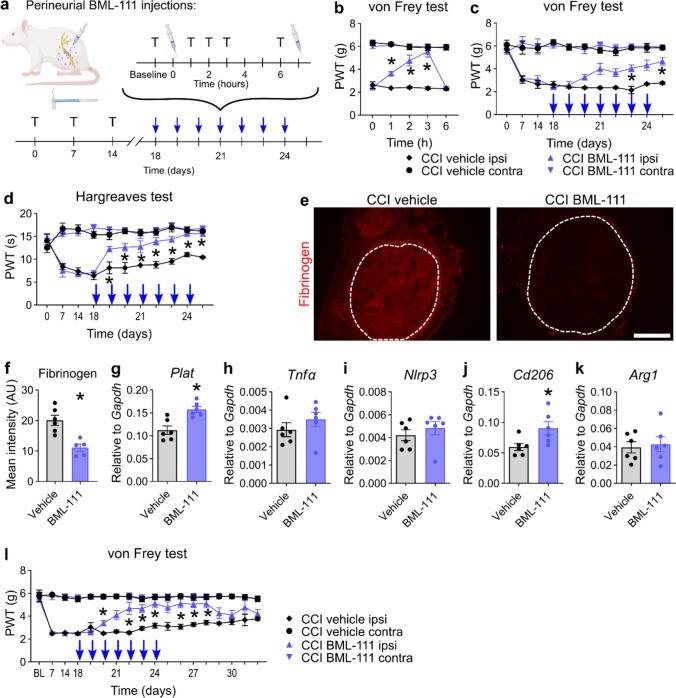
Die lokale Verabreichung sogenannter specialized pro-resolving mediators (SPMs) nach der Nervenverletzung führte zur Schmerzauflösung. Dabei werden Fpr2-Rezeptoren auf Makrophagen im verletzten Nerv aktiviert, wodurch Schwann Zellen angeregt werden, Fibrinogen – das bei Nervenverletzungen vom Blut in den Nerv eindringt – abzubauen. Die Kommunikation zwischen Makrophagen und Schwann Zellen wird über TAM-Rezeptoren vermittelt. Ziel dieser Forschung ist es, Therapien zu entwickeln, die den Heilungsprozess bei chronischen Schmerzerkrankungen fördern und neue Ansätze für die Behandlung von Nervenschmerzen schaffen.
Beate Hartmannsberger, Adel Ben-Kraiem, Sofia Kramer, Carolina Guidolin, Ida Kazerani, Kathrin Doppler, Dominique Thomas, Robert Gurke, Marco Sisignano, Pranav Kalelkar, Andrés J. García, Paula V. Monje, Michael Sammeth, Asma Nusrat, Alexander Brack, Susanne M. Krug, Claudia Sommer, Heile L. Rittner. TAM receptors mediate the Fpr2-driven pain resolution and fibrinolysis after nerve injury. Acta Neuropathol. 2024 Dec 16;149(1):1. doi: 10.1007/s00401-024-02840-9. PMID: 39680199; PMCID: PMC11649718.